Show
Logam alkali tanah
terdiri dari 6 unsur yang terdapat di golongan IIA. Yang termasuk ke dalam
golongan II A yaitu : Berilium (Be), Magnesium (Mg), Calcium (Ca), Stronsium
(Sr), Barium (Ba), dan Radium (Ra). Disebut logam karena memiliki sifat sifat
seperti logam. Disebut alkali karena mempunyai sifat alkalin atau basa jika
direaksikan dengan air. Dan istilah tanah karena oksidasinya sukar larut dalam
air, dan banyak ditemukan dalam bebatuan di kerk bumi. Oleh sebab itu, istilah
“alkali tanah” biasa digunakan untuk menggambarkan kelompok unsur golongan II
A.
Golongan ini mempunyai sifat-sifat yang
mirip dengan golongan IA. Perbedaannya adalah bahwa golongan IIA ini mempunyai
konfigurasi electron ns2 dan
merupakan reduktor yang kuat juga. Meskipun lebih keras dari golongan IA,
tetapi golongan IIA ini tetap relatif lunak, perak mengkilat, dan mempunyai
titik leleh dan kerapatan lebih tinggi.
Sifat Golongan Alkali Tanah
Unsur-unsur logam alkali tanah agak lebih keras daripada golongan logam alkali biasa. Golongan ini mempunyai struktur elektron yang sederhana, unsur-unsur logam alkali tanah mempunyai 2 elektron yang relatif mudah dilepaskan. Maka, selain energi ionisasi yang relatif rendah, keelektronegatifan rata-rata golongan ini juga rendah dikarenakan ukuran atomnya dan jarak yang relatif besar antara electron terluar dengan inti. Jari-jari golongan alkali tanah, Semakin besar nomor atom unsur-unsur segolongan, semakin banyak pula jumlah kulit elektronnya, sehingga semakin besar pula jari-jari atomnya. Jadi, dalam satu golongan (dari atas ke bawah), jari-jari atomnya semakin besar. Jadi, dari atas ke bawah jari-jarinya akan bertambah. Kereaktifan logam alkali tanah meningkat dari berilium ke barium. Fakta ini karena dari berilium ke barium jari-jari atom bertambah besar, energi ionisasi serta keelektonegatifan berkurang. Akibatnya, kecenderungan untuk melepas elektron membentuk senyawa ion makin besar. Semua senyawa dari kalsium, strontium, dan barium, yaitu logam alkali tanah yang bagian bawah, berbentuk senyawa ion sedangkan magnesium membentuk beberapa senyawa kovalen, dan senyawa-senyawa berilium bersifat kovalen. Pada dasarnya logam alkali tanah mengalami reaksi redoks yang sama dengan logam alkali, hanya saja mereka melepaskan 2 elektron sehingga membentuk ion 2+. Logam alkali tanah cenderung kurang reaktif dibandingkan dengan logam alkali karena energi ionisasinya lebih besar daripada logam alkali tanah. Reaksi pada Logam Alkali Tanah A. Logam Alkali Tanah Bereaksi dengan Halogen Logam alkali tanah bereaksi dengan halogen membentuk garam halide (MX2) B. Logam Alkali Tanah Bereaksi dengan Oksigen Logam alkali tanah bereaksi dengan oksigen membentuk oksida (MO). Berilium dan magnesium tidak begitu reaktif jika direaksikan dengan oksigen pada suhu kamar, tetapi keduanya mengeluarkan cahaya putih cerah jika dibakar dengan nyala api. Sedangkan kalsium, stronsium, dan barium cukup reaktif sehingga perlu disimpan di bawah minyak agar tidak kontak dengan udara. Seperti logam berat alkali, stronsium dan barium membentuk peroksida (MO2) C. Logam Alkali Tanah Bereaksi dengan Air Logam alkali tanah bereaksi dengan air membentuk logam hidroksida [M(OH)2]. Reaksi: M(s) + 2 H2O(l) → M2+(aq) + 2 OH– (aq) + H2 (g) dengan M = Mg, Ca, Sr, atau Ba Semua logam alkali tanah bereaksi dengan air membentuk logam hidroksida M(OH)2. Magnesium bereaksi hanya jika suhu di atas 100 °C, sedangkan untuk kalsium dan stronsium, reaksi berjalan lambat dan pada suhu kamar. Hanya barium yang bereaksi dengan baik.
Dari namanya juga sudah kita ketahui sebagai unsur periode ketiga , berarti unsur-unsur ini di antaranya adalah : Natrium(Na),magnesium(Mg), aluminium(Al), silikon(Si), fosfor(P), sulfur(S), klorin(Cl) dan argon(Ar). Unsur tersebut terletak dalam golongan yang berlainan, berikut tabel mengenai letak unsur periode 3: Na Mg Al Si P S Cl Ar IA,IIA,IIIA (Logam) IVA (Metaloid) VA,VIA,VIIA (Non-metal) VIIIA (gas mulia) Sifat dan Ciri Unsur Periode ketiga Unsur-unsur yang ada di dalam periode ketiga terdiri dari unsur logam (Na, Mg, Al), metaloid (Si), nonlogam (P, S, Cl), dan gas mulia (Ar). Dari tabel dapat dilihat bahwa keelektronegatifan unsur-unsur periode ketiga semakin ke kanan semakin besar diakibatkan oleh jari-jari atomnya yang semakin ke kanan semakin mengecil. Kekuatan ikatan antar atom dalam logam meningkat (dari Na ke Al). Hal ini berkaitan dengan pertambahan electron valensinya. Dalam peri
Gas mulia adalah unsur-unsur yang terdapat dalam golongan VIIIA yang memiliki kestabilan yang sangat tinggi dan sebagian ditemukan di alam dalam bentuk monoatomik. Unsur ini adalah unsur non-logam. Unsur-unsur yang terdapat dalam gas mulia yaitu Helium (He), Neon (Ne), Argon(Ar), Kripton(Kr), Xenon (Xe), Radon (Rn). Gas-gas ini pun sangat sedikit kandungannya di bumi. Dalam udara kering maka akan ditemukan kandungan gas mulia sebagai berikut : Nama Gas Mulia Kadar di Bumi Helium 0,00052 % Neon 0,00182 % Argon 0,934% Kripton 0,00011% Xenon 0,000008% Radon -radioaktif- Sebenarnya, di alam semesta kandungan Helium paling banyak diantara gas mulia yang lain karena Helium meupakan bahan bakar dari matahari. Radon amat sedikit jumlahnya di atmosfer atau udara. Dan sekalipun ditemukan akan cepat berubah menjadi unsur lain, karena radon bersifat radio aktif. Dan kar
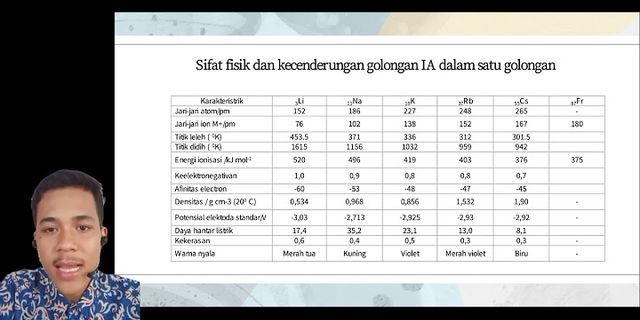
Ah.. gaada kerjaan. Gatau mau nge-post apa. Mending nge-post hasil kerjaan tugas kimia aja kali, ya ? okedeh, daripada mikirin ulangan fisika tadi yang zonk. Langsung aja deh. Unsur logam alkali (IA) terdiri dari litium, natrium, kalium, rubidium, sesium, dan fransium (zatradioaktif). Unsur-unsur ini berada di golongan pertama atau IA. Unsur ini mempunyai energi ionisasi paling kecil karena mempunyai konfigurasi elektron ns1. Oleh karena itu, unsur logam alkali mudah melepaskan elektron dan merupakan reduktor yang paling kuat. Semuanya merupakan unsur logam yang lunak (mudah diiris dengan pisau). Pada saat logam dibersihkan, terlihat warna logam putih mengkilap (seperti perak). Disebut logam alkali karena oksidanya mudah larut dalam air dan menghasilkan larutan yang bersifat basa (alkalis). Semua logam alkali sangat reaktif sehingga di alam tidak pernah diperoleh dalamkeadaan bebas. Di alam terdapat dalam bentuk senyawa. Sifat-Sifat Logam Alkali Sifat Fisis Sifat u Unsur-unsur golongan IA (kecuali hidrogen) disebut logam alkali. Unsur-unsur golongan IIA disebut logam alkali tanah. Kata “alkali” berasal dari bahasa Arab, al-qaly, yaitu abu yang dalam air bersifat basa. Oleh karena logam-logam golongan IA dan IIA umumnya jika dilarutkan dalam air membentuk larutan basa, maka disebut logam alkali dan alkali tanah. Sebutan alkali tanah untuk logam golongan IIA dikarenakan logam-logam tersebut umumnya ditemukan dalam bentuk senyawa sukar larut di dalam tanah. Logam alkali dan alkali tanah bersifat sangat reaktif sehingga selalu ditemukan di alam dalam bentuk senyawanya, meskipun logam alkali tanah tidak sereaktif logam alkali. Logam AlkaliUnsur-unsur golongan IA terdiri dari hidrogen (H), litium (Li), natrium (Na), kalium (K), rubidium (Rb), sesium (Cs), dan fransium (Fr). Unsur-unsur ini kecuali hidrogen, dikenal sebagai logam alkali. Keberadaan Logam Alkali di Alam Sifat-sifat Logam Alkali Sifat atomikKonfigurasi elektron valensi logam alkali adalah ns1. Oleh karena itu, atom logam alkali cenderung mudah melepaskan sebuah elektron membentuk ion bermuatan +1 dengan konfigurasi elektron stabil gas mulia. Hal tersebut juga dapat dilihat dari energi ionisasinya yang relatif rendah. Selain itu, perbedaan energi ionisasi pertama dan kedua juga sangat besar. Secara umum, keteraturan sifat dari Li ke Fr, yaitu:
Sifat fisisTitik leleh, titik didih, dan kekerasan logam alkali tergolong relatif rendah. Dari Li ke Fr, titik leleh, titik didih, dan daya hantar listrik dan panas semakin menurun, kecuali daya hantar listrik dan panas pada logam Na dan K justru bertambah. Hal ini terkait dengan ikatan logam pada logam alkali. Semakin banyak elektron yang terlibat pada pembentukan ikatan logam, semakin kuat ikatan; semakin besar jari-jari atom, semakin lemah ikatan. Pada atom Na dan K elektron cenderung lebih mudah bergerak bebas. Sifat kimiaLogam alkali bersifat sangat reaktif, sebagaimana terlihat dari energi ionisasinya yang relatif rendah. Kereaktifan logam alkali meningkat dari Li ke Fr, begitu juga dengan sifat reduktor yang semakin kuat. Hampir senyawa logam alkali bersifat ionik dan mudah larut dalam air. Semua logam alkali bereaksi dengan air membentuk basa dan gas hidrogen. Li bereaksi agak pelan; Na bereaksi hebat dengan percikan api; K, Rb, dan Cs meledak jika dimasukkan dalam air. Oleh karena reaksi tersebut sangat eksoterm, gas hidrogen yang terbentuk akan langsung terbakar. 2L(s) + 2H2O(l) → 2LOH(aq) + H2(g) (L = logam alkali) Jika dipanaskan, logam alkali dapat bereaksi dengan gas hidrogen membentuk senyawa ionik alkali hidrida. 2L(s) + 2H2(g) → 2LH(s) (L = logam alkali) Logam alkali dapat bereaksi dengan oksigen membentuk oksida, peroksida, ataupun superoksida. Dalam jumlah oksigen terbatas umumnya terbentuk oksida. 4L(s) + O2(g) → 2L2O(s) (L = logam alkali) Namun, jika oksigen berlebihan, Na dapat membentuk peroksida, sedangkan K, Rb, dan Cs dapat membentuk superoksida. 2Na(s) + O2(g) → 2Na2O2(s) K(s) + O2(g) → KO2(s) Logam alkali bereaksi dengan halogen (F2, Cl2, Br2, I2) membentuk senyawa garam halida. 2L(s) + X2 → 2LX(s) (L = logam alkali; X = halogen) Warna nyalaKetika dipanaskan dengan suhu tinggi, setiap unsur akan memancarkan radiasi elektromagnetik yang khas. Hal ini terjadi akibat elektron pada atom unsur mengalami eksitasi atau perpindahan ke tingkat energi yang lebih tinggi, dan ketika elektron tersebut kembali ke tingkat energi semula diikuti pancaran foton. Keunikan spektrum radiasi elektromagnetik tersebut dapat digunakan untuk mengenali suatu unsur. Pada pembakaran unsur atau senyawa logam alkali pada nyala api, elektron pada atom setiap unsur logam alkali akan tereksitasi dan menghasilkan warna nyala yang khas.  Logam Alkali TanahUnsur-unsur golongan IIA yang dikenal sebagai logam alkali tanah terdiri berilium (Be), magnesium (Mg), kalsium (Ca), stronsium (Sr), barium (Ba), dan radium (Ra). Keberadaan Logam Alkali Tanah di Alam Sifat-sifat Logam Alkali Tanah Sifat atomikKonfigurasi elektron valensi logam alkali tanah adalah ns2. Atom logam alkali tanah juga cenderung mudah melepaskan sepasang elektron membentuk ion bermuatan +2 dengan konfigurasi elektron stabil gas mulia. Namun, energi ionisasinya lebih tinggi dibanding logam alkali karena jari-jari atomnya lebih kecil dan elektron valensinya lebih banyak. Secara umum, keteraturan sifat dari Be ke Ba, yaitu:
Sifat fisisDari Be ke Ba, titik leleh, titik didih, dan daya hantar listrik dan panas cenderung menurun. Jika dibandingkan dengan logam alkali seperiode, titik leleh dan sifat-sifat fisis lainnya seperti rapatan dan kekerasan dari logam alkali tanah lebih besar. Sifat kimiaSifat kimia logam alkali tanah hampir sama dengan logam alkali, tetapi logam alkali tanah tidak sereaktif logam alkali seperiode. Kereaktifan logam alkali tanah meningkat dari Be ke Ba. Nilai potensial standar logam alkali tanah menunjukkan bahwa logam alkali tanah merupakan reduktor yang cukup kuat, bahkan Ca, Sr, dan Ba mempunyai daya reduksi yang lebih kuat dari Na. Ca, Sr, dan Ba bereaksi dengan air membentuk basa dan gas hidrogen. Magnesium bereaksi sangat lambat dengan air dingin. Berilium tidak bereaksi dengan air. M(s) + 2H2O(l) → M(OH)2(aq) + H2(g) (M = Mg, Ca, Sr, Ba) Jika dipanaskan, logam alkali tanah dapat bereaksi dengan gas hidrogen membentuk senyawa ionik alkali hidrida. M(s) + 2H2(g) → MH2(s) (M = Mg, Ca, Sr, Ba) Logam alkali tanah bereaksi dengan halogen membentuk senyawa garam halida. M(s) + X2 → MX2(s) (M = logam alkali tanah; X = halogen) Jika dipanaskan, logam alkali tanah dapat bereaksi dengan nitrogen dan oksigen di udara membentuk nitrida dan oksida. 3M(s) + N2(g) → M3N2(s) 2M(s) + O2(g) → 2MO(s) (M = logam alkali tanah) Warna nyalaLogam alkali tanah juga mempunyai warna nyala yang khas sebagaimana logam-logam alkali.  KelarutanSebagian besar senyawa-senyawa logam alkali tanah memiliki kelarutan yang kecil atau sukar larut dalam air. Hal ini membedakannya dari senyawa logam alkali yang umumnya mudah larut dalam air. Berdasarkan data tetapan hasil kali kelarutan (Ksp), kecenderungan periodik dari kelarutan senyawa-senyawa logam alkali tanah, yaitu:
 Contoh Soal Logam Alkali dan Alkali Tanah dan PembahasanContoh Soal 1:Keteraturan yang tampak pada unsur-unsur logam alkali dari urutan atas ke bawah golongan adalah … a. kerapatan semakin kecil b. jari-jari logam semakin kecil c. jari-jari ionik semakin kecil d. titik didih semakin kecil e. kekerasan semakin besar Jawab: D Dari atas ke bawah golongan jari-jari atom logam alkali semakin kecil sehingga ikatan logamnya juga semakin lemah. Akibatnya, sifat fisis seperti titik didih, titik leleh, dan kekerasan juga semakin rendah. Contoh Soal 2:Logam alkali tanah berikut yang tidak menghasilkan gas hidrogen jika bereaksi dengan air adalah … a. barium b. stronsium c. magnesium d. kalsium e. berilium Jawab: E Berilium tidak bereaksi dengan air. Contoh Soal 3:Senyawa sulfat dari logam alkali tanah berikut yang paling mudah larut adalah … a. BaSO4 Jawab: B Kelarutan senyawa sulfat dari logam alkali tanah menurun dari atas ke bawah golongan. Referensi Johari, J.M.C. & Rachmawati, M. 2008. Kimia SMA dan MA untuk Kelas XII Jilid 3. Jakarta: Esis Retnowati, Priscilla. 2006. SeribuPena Kimia SMA Kelas XII Jilid 3. Jakarta: Erlangga Kontributor: Nirwan Susianto, S.Si. Materi StudioBelajar.com lainnya:
|

Pos Terkait
Periklanan
BERITA TERKINI
Toplist Popular
#1
#2
#4
#5
#6
#7
Top 8 apa itu benedict dan biuret? 2022
1 years ago#8
#9
#10
Top 6 apa itu self pick up grabfood? 2022
2 years agoPeriklanan
Terpopuler
Periklanan
Tentang Kami
Dukungan

Copyright © 2024 toptenid.com Inc.